Вода – это не просто так, от нее зависит жизнь и здоровье рыбок.
Это одно из самых необычных, самых чудесных веществ на нашей Земле. И у воды есть множество характеристик.
Что же должен знать о ней человек, который держит рыбок в аквариуме?
Во-первых, вода – хороший растворитель. Иначе мы ею бы не умывались! :-)
Помимо прочего, она способна растворять в себе большое
количество газов (это называется обогащение). Именно этими,
растворенными в воде газами, и дышат все водные обитатели.
В аквариуме обогащение воды газами происходит
несколькими путями: газы проникают через поверхность воды, газы
вырабатываются в результате жизни водных обитателей и газами вода
насыщается с помощью специальных устройств (аэраторов, фильтров и т. п.)
Вот какие газы растворены в воде:
Кислород (O2).
Кислород вырабатывают растения в процессе фотосинтеза. Это первый путь.
Второй – это когда кислород поступает в воду из атмосферы.
Из-за этого, кислорода всегда больше в верхнем слое воды
в аквариуме. А дышать хочется всем, и тем, кто может плавать у
поверхности, и тем, кто обречен жить на дне.
Поэтому, чтобы распределить кислород равномерно по всем
слоям аквариума, нужно постоянно воду перемешивать с помощью аэратора и
фильтра.
Но количество кислорода в воде не всегда одинаково: в
соленой воде его меньше чем в пресной, и теплой меньше чем в холодной.
Чем больше температура воды, – тем меньше в ней становится кислорода.
Очень часто рыбок лечат солевыми ваннами или отсаживают
для нереста в более теплую воду, чем обычно. Здесь потеря кислорода
неизбежна, поэтому обязательно нужна аэрация.
Разным рыбкам для дыхания нужно разное количество
кислорода. Например, макропод имеет более скромные запросы, чем лялиус,
хотя они и родственники.
А есть рыбки, которые могут дышать и атмосферным
кислородом, если уж совсем деваться некуда. Но дополнительные органы
дыхания у них появляются не сразу, а через определенное время после
вылупления из икры (от трех недель до нескольких месяцев).
Если кислорода в воде растворено недостаточно, то рыбки
начинают плохо расти: аппетит у них может и не пропасть, но питательных
веществ будет усваиваться меньше.
Это особенно важно для молодых рыбок: ведь они должны
вырасти большими (для своего вида) и здоровыми. Поэтому в аквариумах,
где их выращивают, обязательно делают постоянную аэрацию и водообмен.
Углекислый газ (CO).
Углекислый газ тоже постоянно присутствует в аквариуме.
Ведь его выделяют и рыбки, и растения, когда дышат.
Причем рыбки могут выделять его не только через жабры, но и через кожу
(до 90 %) – так приспособились делать многие вьюны.
Слишком большое количество углекислого газа в воде ведет
к удушью рыб. Это происходит, когда в аквариуме чересчур много рыбок и
растений.
Но удушье – это уже заключительная стадия, неприятности в аквариуме начинаются гораздо раньше.
Незаметно, тихо у рыбок наступает изменение обмена
веществ. Едят они с аппетитом, но пища не усваивается, как положено и на
самом деле рыбки голодают и медленно истощаются. А виной всему
повышение концентрации углекислого газа в воде.
Углекислый газ удаляется из воды растениями в дневное
время, – когда они под воздействием света поглощают его и вырабатывают
кислород. Так же его количество снижается, если повышается температура
воды и соленость. Для большинства организмов, живущих в воде, углекислый
газ ядовит.
Казалось бы, чем меньше углекислого газа, – тем лучше. Но нет – при недостатке углекислого газа начинают страдать растения.
Это происходит в аквариумах, где много растений и нет,
или очень мало рыбок (ведь есть люди, которым очень нравятся именно
подводные сады, а не рыбки!).
Углекислый газ для растений – то же самое, что для нас с вами еда.
Ночью растения не вырабатывают кислород, – они дышат и
выделяют углекислый газ, как и все остальные обитатели аквариума. А
утром, когда рассветет, начинают «съедать» выделенный за ночь углекислый
газ, строя свое тело.
Но углекислого газа от одних растений получается мало и
они «съедают» его еще до обеда. А больше есть нечего, – наступает голод.
Растения перестают расти, потом у них начинают разрушаться листья и
стебли.
От этой беды растения спасают рыбки, выделяющие
углекислый газ в процессе дыхания. Вот почему даже в аквариумах,
созданных исключительно ради водных растений, поселяют достаточное
количество рыбок.
Сероводород (H2C)
Сероводород образуется в стареющих аквариумных системах.
В основном его выделяют гнилостные бактерии. Они питаются гнилью,
образующейся на грунте, куда падают остатки несъеденного корма.
Опасность сероводорода заключается не только в нем
самом, но еще и в том, что он участвует в химических процессах, которые
уменьшают количество кислорода в воде.
Метан (CH4) (болотный газ).
Метан (а болотным газом его называют, потому что много
метана на болотах) образуется около дна, в грунте, где разлагаются
отмершие части растений, погибшие организмы. Метан вносит свою лепту в
отравление аквариума.
Гидрохимический состав воды
Именно потому, что вода хороший растворитель, чистой воды в природе почти нет!
В лабораториях получают дистиллированную – почти чистую воду.
А подземные, речные, водопроводные воды имеют сложный химический состав.
В воде водоемов, где живут самые разнообразные обитатели
и растут самые разнообразные растения, идут сложные биологические
процессы, меняющие химический состав воды и насыщающие ее органическими
веществами. Все это и определяет химический состав воды в аквариуме.
Аквариумисты должны постоянно учитывать некоторые параметры воды, знать, какие химические реакции в ней происходят.
Поэтому они пользуются специальными терминами, которые
встречаются в любой литературе по аквариумистике, такими как жесткость
воды, водородный показатель pH, редокс-потенциал. Без этих терминов
аквариумисту никуда...
Что же это такое?
Постараемся разобраться! (А лучше всего привлечь родителей – пусть помучаются! :-))
Активная реакция воды (водородный показатель pH)
Химическая формула воды H2O.
Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Но под влиянием слабого природного электричества часть молекул воды распадается на ионы. Этот процесс называется диссоциацией.
Соли, кислоты и щелочи, которые растворены в воде, тоже распадаются на ионы.
Ионы воды обозначают так: H+ (свободные водородные ионы)
и OH– (гидроксильная группа). Плюс на минус дает сами знаете что. То
есть если тех и других в воде поровну, то говорят, что вода имеет
нейтральную реакцию.
В нейтральной воде распадается (диссоциирует) примерно одна молекула на каждые 10 000000.
То есть в ней ионов водорода 10 в минус 7 степени: 10 -7. (И ионов гидроксильной группы OH– тоже 10 -7.).
Активная реакция такой воды обозначается водородным
показателем с цифрой 7. Почему 7, а не 6 или не 10? Посчитайте нули в
десяти миллионах! Записывают водородный показатель латинскими буквами
pH. И говорят, что у нейтральной воды pH7.
Если же в воде оказывается больше ионов водорода (Н+),
вода становится кислой, если ионов гидроксильной группы (ОН-), то
щелочной.
В качестве показателя активной реакции воды будет
десятичный логарифм показателя ионов с обратным знаком. (А логарифм,
если кто забыл, это вот что: x=10y, ® y=lgx, обратный же знак, потому,
что у ионов водорода, растворенных в воде степень минусовая, их же там
очень мало). (Вы что-нибудь поняли? Один из авторов этой книги понимает и
уверен, что все ясно, яснее некуда, другой ни черта не понял! :-))
Это была теория. Можно ее забыть, если кроме головной боли она ничего не вызывает.
Что нужно помнить:
Чтобы узнать, сколько этого самого pH, то есть водородного показателя в воде, придумали шкалу с делениями от 0 до 14.
Нейтральный показатель pH (наиболее предпочтительный) –
это деление под номером 7, ровно посередине шкалы. Пишется это, как мы
уже знаем, pH7.
Влево от него идут кислые воды (слабокислая – кислая –
сильнокислая), вправо – щелочные (слабощелочная – щелочная –
сильнощелочная).
Вот как меняется отношение ионов водорода к ионам гидроксильной группы, если посмотреть на показатели pH:
pH 7
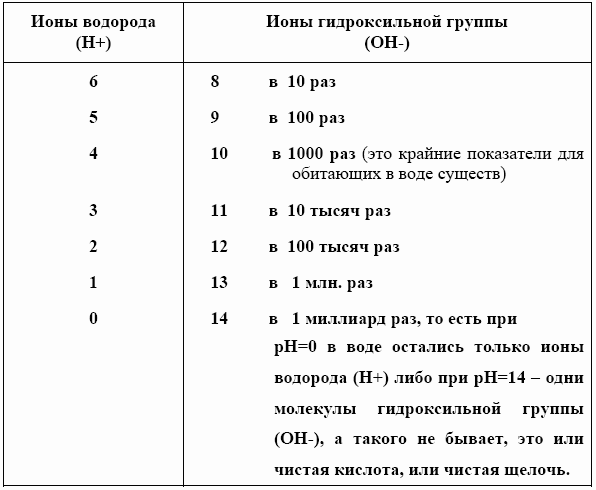
Жизнь
в воде возможна в пределах pH 4 – 10. Показатель pH у морской воды
равен 8,1–8,3. А вот у пресной воды разброс по шкале сильнее.
Учитывая, что рыбки могут жить в пределах pH от 5 до 9, воду можно разделить так:
pH <5 – сильно кислая,
pH 5–6 – кислая,
pH 6–6,8 слабо кислая,
pH 6,8–7,2 – нейтральная,
pH 7,2–8,0 слабо щелочная,
pH 8,0–9,0 – щелочная,
pH>9 – сильно щелочная.
Показатель pH вообще очень нестабилен: он зависит от
температуры воды, от жизнедеятельности растений (значит и от освещения),
от того, подвижна ли вода в водоеме или нет.
Разные слои воды могут иметь разный показатель pH. Днем,
когда водные растения вырабатывают кислород в процессе фотосинтеза, они
подщелачивают воду и pH поднимает вправо по шкале. Но достаточно подуть
ветерку над озером, или заработать фильтру в аквариуме, как pH разных
слоев уравнивается.
Это еще одна причина, по которой стоячая вода для
аквариума – смерть! Потому что без вертикального вращения воды в
аквариуме, растения могут так повысить pH в верхних слоях, что у них
начнется разрушение листьев и стеблей.
В большинстве случаев показатель pH аквариумной воды
колеблется в рамках 6,5–8,5. Но если аквариум сильно загрязнен, давно
нечищен и грунт его закис, то водородный показатель у дна может
составить и pH 5,5.
Если в аквариуме есть растения, то днем pH, как мы уже
говорили, перемещается в щелочную сторону, а ночью, когда они не
вырабатывают, а потребляют кислород – в кислую сторону.
Но при всей этой подвижности водородного показателя
pH, у обитателей аквариума есть свои рамки. Они называются pH – барьеры.
И выход за них в любую сторону по шкале водородного показателя (в
кислую или в щелочную) – гибелен.
Так, если перенести аквариумных жителей из одной воды в
другую, которые отличаются своим pH больше чем на 0,8–1,0 – то рыбки
могут получить сильнейший шок, а у растений начнут отмирать листья и
стебли.
Все это происходит потому, что в природе и рыбки, и
растения живут в разных условиях. Кто-то в быстрой речке, кто-то в
спокойном озере. А раз условия разные, то и pH – барьеры тоже разные.
Если в аквариуме посажены растения с разными
pH-барьерами, это может привести к явлению, которое принято называть
несовместимостью.
Например, широко распространены в аквариумах три таких
растения, как кабомба, валлиснерия и элодея. У кабомбы граница
pH-барьера в щелочную сторону заканчивается на 8. В более щелочной воде
она прекращает вырабатывать кислород и потреблять углекислый газ (а
значит, и расти). У валлиснерии эта граница на pH 10, а у элодеи на pH
11.
Если эти три растения будут вместе, элодея будет
подщелачивать верхние слои воды без всякого для себя вреда, а кабомба и
валлиснерия не смогут выдержать рядом с ней и будут потихоньку отмирать,
потому что при таких показателях pH расти не смогут.
Рыбки тоже сильно реагируют на изменение показателя
pH. От его снижения у них может повыситься аппетит, но это такое же
обманчивое явление, как и при избытке углекислого газа. На самом деле
рыбки не могут усвоить питательные вещества и голодают.
Некоторые рыбки (барбусы и др.) начинают чесаться о
грунт и камни, а сомики, несмотря на отменный аппетит, умирают от
истощения. Кровь начинает хуже захватывать кислород, и, несмотря на
усиленное дыхание, рыбки задыхаются.
Но иногда, чтобы спровоцировать нерест у рыб, нужно
изменить им показатель pH на короткий срок. Поэтому при описании рыбок
очень часто указывают два необходимых им показателя рН: один нужен для
жизни, другой для нереста.
Наиболее подходящая вода для большинства обитателей аквариума должна иметь колебания pH около 7.
Этого достигают, в основном, правильно ухаживая за
аквариумом: поддерживают постоянное принудительное ее перемешивание с
помощью аэрации и фильтрации, регулярно (обычно еженедельно) меняют
часть воды, следят за чистотой в водоеме.
Показатель pH – штука сложная и изменчивая. Попробуй-ка ее определи на глаз! Но есть более стабильный показатель.
Это:
Жесткость воды
Жесткость воды зависит от присутствия в ней растворенных солей кальция (Ca) и магния (Mg).
Жесткость подразделяется на временную, карбонатную (Ca,
MgCO3), от которой легко избавиться кипячением, и постоянную,
некарбонатную.
Ионы кальция и магния имеют знак «+» и обозначаются как
Ca++, Mg++. Они называются катионами и связаны с различными анионами со
знаком «-». (Если разделить соль кальция CaCO3, то Ca++ – это катион, а
остаток CO3– соответственно анион).
Карбонатная жесткость – это когда катионы связаны с анионами угольной кислоты.
Некарбонатная жесткость – если катионы связаны с анионами хлора, соединениями серы, азота, фосфора, кремния и т. д.
Если значение pH более 8,3, то осадок карбонатов может частично перейти обратно в раствор.
Для измерения жесткости воды аквариумисты пользуются
немецкими градусами жесткости dGH (deutsche Gesamt Harte). Общая
жесткость здесь обозначается dH или GH, а временная – KH (Karbonat
Harte).
Один градус жесткости dGH означает, что в одном литре воды растворено 10 мг CaO.
Для особо дотошных:
В бывшем СССР за единицу жесткости воды принят
миллиграмм-эквивалент/литр, то есть 1 мг экв/л равен 20,4 мг кальция или
12,4 мг магния.
Этот показатель отличается от немецкого градуса жесткости, от английского, американского и французского.
1 мг экв/л равен: 2,8 немецкого градуса,
3,5 английского градуса (А),
2,91 американского градуса(Аm)
5,0 французского градуса (ТН).
У общей жесткости воды, так же как у показателя pH, есть своя шкала показателей dH.
Воду разделяют так:
> от 0 до 4 dH – очень мягкая,
> от 5 до 10 dH – мягкая,
> от 11 до 18 dH – средней жесткости,
> свыше 30 dH – очень жесткая.
В природе общая жесткость воды меняется в воде в течение всего года.
Она может увеличиться из-за испарения воды – ведь
концентрация солей кальция и магния тогда станет больше. А может
уменьшиться из-за дождей, или таяния снега и льда, когда мягкая вода
попадет в водоем.
В разных городах общая жесткость воды тоже разная.
Так в Москве общая жесткость воды колеблется от 4 до 14dH,
в Санкт-Петербурге от 2 до 3 dH,
в Саратове от 9 до 14 dH,
в Одессе от 12 dH и выше,
в Риге от 6 до 12 dH.
Рыбкам и растениям нужна вода определенной
жесткости. Это тоже всегда указывается в их описаниях, наряду с pH.
(Например так: жесткость воды 5 – 20 dH, pH около 7. Иногда вместо dH
ставят значок градуса °).
А многие рыбки могут разводиться только в мягкой воде
(например, на родине они нерестятся после сезона дождей, когда вода в
водоемах разбавляется дождевой и становится мягкой). Поэтому
аквариумисту приходится общую жесткость воды уменьшать.
Сделать это можно, добавив дистиллированную, дождевую,
снеговую, или сделанную из растаявшего льда воду. Или с помощью
специальных ионообменных смол (анионит и катионит).
Поскольку зима у нас долгая и холодная, аквариумисты
нашли способ достаточно просто получить много мягкой воды. Это делают
вымораживанием.
Для вымораживания нужна вода, ведро и мороз.
Водопроводную воду наливают в ведро, выставляют на холод (зимой – на
балкон) и замораживают.
Вода замерзает постепенно, начиная со стенок. Замерзая,
она «оттесняет» растворенные соли в центр ведра. Этот рассол
превращается в лед в последнюю очередь. Главное – не прозевать момент и
дождаться, чтобы жидкой осталась примерно 1/3 – ? часть воды. Тогда
ледяное ведро пробивают, концентрированный рассол сливают, а лед
растапливают.
А раньше изготовленное подобным образом ледяное ведро в
Сибири охотники использовали для ловли горностаев и других мелких
хищников. Его закапывали на тропе, а внутрь кидали клочок сена и
спускали живую мышку в качестве приманки. Горностай за мышкой проникал
через пробитую дыру вовнутрь ледяного ведра, а выбраться обратно по
скользким ледяным стенкам не мог. :-)
Но мягкая вода создает перед аквариумистами и
проблемы: показатель pH в ней сильно колеблется. А в жесткой воде
кальций и магний играют роль буфера, который тормозит эти колебания.
И в городах, где водопроводная вода мягкая (а значит
карбонатная или временная жесткость воды невысока), аквариумисты могут
столкнуться с тем, что по ночам в аквариумах могут происходить заморы –
будут гибнуть рыбки, для которых сильные сдвиги pH смертельны, и хиреть
растения.
Там же, где вода имеет жесткость выше 6 dH, таких неприятностей можно не опасаться.
Добавление 1 мл 10 % раствора хлористого кальция
увеличивает жесткость литра воды примерно на 2,9 dH, а 1 мл 25 %
раствора сульфата магния – на 4 dH.
Если pH и жесткость воды вас не испугала, то честь вам и хвала!
Но мы на этом не остановимся. Теперь нас интересует:
Редокс-потенциал среды
И снова химия... :-(
Активная реакция воды (pH) очень влияет на жизнь в водоеме.
Но так же жизнь всех его обитателей зависит от окислительно-восстановительного потенциала. Его называют редокс-потенциал.
Чем же важен редокс-потенциал?
Он стимулирует или наоборот тормозит рост и развитие водных организмов.
О растворенном в воде молекулярном кислороде мы уже
говорили. Им дышат животные и растения, он попадает в воду или через
поверхность, или в результате фотосинтеза, или посредством аэрации.
А сейчас мы будем говорить об атомарном кислороде, который содержится в молекуле воды H2O.
В слове редокс зашифровано два понятия: восстановление (редукция) и окисление (оксидация).
Редукция – это процесс выделения кислорода или поглощения водорода. Оксидация – процесс поглощения кислорода.
Когда идут окислительные или восстановительные реакции,
одно вещество, отдавая свои электроны и заряжаясь положительно,
окисляется, другое, приобретая электроны и заряжаясь отрицательно, –
восстанавливается. Их электрические потенциалы изменяются.
А разность электрических потенциалов между ними и называют редокс-потенциал.
Чем выше концентрация веществ, которые способны
окисляться, к концентрации веществ, способных восстанавливаться, тем
выше показатель редокс-потенциала.
Что же из всего этого значит?
А это значит, что как только аквариум оборудован и
начинает жить, в нем постоянно происходят невидимые нам окислительные и
восстановительные реакции. Он как бы полон сил и энергии.
Про только что устроенный аквариум говорят, что в нем
высокий редокс-потенциал. Сразу после оборудования в процессы окисления
включаются неорганические вещества. Потом в аквариум заселяют растения и
рыбок, – это усиливает окислительные процессы. В них включаются
погибшие части корней и листьев, выделения животных, массовое появление,
а затем гибель бактерий.
Но вот проходит время, водоем стабилизируется, грунт в
аквариуме заиливается, вода «стареет». Он становится похож на пожилого
человека, в котором уже нет энергии молодости.
В «постаревшем» аквариуме с заиленным грунтом и «старой» водой активнее протекают процессы восстановления.
Примерно так выглядит процесс, если описать его предельно упрощенно.
В лабораториях электрохимии показатель редокс-потенциала
измеряют сложными приборами с платиновыми электродами. Величину
редокс-потенциала обозначают как Eh и записывают в милливольтах.
А биохимики переводят эти измерения в свои единицы, которые называют rH (reduktion Hydroqenii).
Для редокс-потенциала биохимики создали, разумеется, тоже шкалу, как и для жесткости воды, как и для pH.
Они разделили ее на 42 деления. В этой шкале 0
обозначает чистый водород, 42 – чистый кислород. Жить рядом с этими
показателями невозможно.
Поэтому в природных водоемах с пресной водой величина редокс-потенциала rH, подходящая для жизни, находится между 25 и 35.
В аквариуме рамки еще меньше: между 26 и 32 rH.
А как же узнать несчастному аквариумисту, какова
величина редокс-потенциала у него в аквариуме? Приборы с платиновыми
электродами ведь на дороге не валяются! :-)
А аквариумист вовсе не несчастный, а очень даже
счастливый. Потому что он смотрит на растения! Они тоже могут служить
своеобразными приборами, хоть и без электродов из драгоценных металлов.
Если бурно разрастаются сине-зеленые водоросли, то редокс-потенциал высокий.
Если бурно разрастаются зеленые водоросли, редокс-потенциал все еще высокий, но несколько ниже.
Аквариумные цветковые растения развиваются при 29–30 rH.
Апоногетоны обильно цветут при 30,2 – 30,6 rH, а уже при 31 сбрасывают листья.
Эхинодорусы при 30,2 – 30,6 rH болеют и перестают расти.
Если показатель редокс-потенциала выше 31 rH, апоногетоны и эхинодорусы теряют корневища.
Криптокорины чувствуют себя хорошо при величине редокс-потенциала 26–29. Повышение rH может привести к их гибели.
Значение редокс-потенциала очень зависит от состояния
грунта. В придонных слоях воды он более низок, чем в верхних, а у
поверхности грунта он больше, чем в самом грунте (если грунт сильно
слежался).
И чем больше скапливается в грунте веществ, которые способны отдавать электроны, тем больше снижается редокс-потенциал.
А чтобы аквариум был здоров и редокс-потенциал в нем
находился на нужном уровне, надо держать его в чистоте и время от
времени промывать грунт.
Активная реакция воды, ее жесткость и
редокс-потенциал позади, осталось узнать про превращения одного очень
важного для аквариумных жителей газа:
Азот и его соединения
В воде постоянно происходит круговорот азота, почти так
же, как круговорот воды в природе. И на некоторые моменты этого
круговорота, нужно обратить внимание.
Ведь с одной стороны соединения азота очень нужны
растениям и водным жителям, но с другой – они могут и отравить. Нас
будут интересовать такие азотные соединения, как аммоний, нитриты и
нитраты.
Аммоний
Аммоний в аквариуме образуется в результате гниения
несъеденного корма, отмерших частей растений, трупиков рыб, которые
содержат соединения азота. Когда эти останки гниют, сложные
азотсодержащие вещества в них превращаются в аммиак и воду.
Аммиак (NH3) в небольших количествах служит растениям удобрением, но в больших количествах он ядовит.
Аммоний – это сумма ионов аммония(NH4+) и свободного
аммиака. Рыбы выделяют аммоний через жабры: на поверхности жабр
происходит обмен ионов аммония на ионы натрия. А ионы натрия нужны
клеткам организма рыб.
Если в аквариуме слишком много обитателей, а вода
регулярно не подменивается, рыбки не могут избавиться от избытка аммония
и он накапливается в организме в ходе азотного обмена. И рыбки
отравляются им и аммиаком.
Если показатель pH в аквариуме высок, более ядовитым будет аммиак.
А если в воде низкое содержание кислорода, и аммиак, и аммоний становятся еще токсичнее.
При отравлении аммонием у рыб учащается дыхание даже в
аэрируемом водоеме, но уменьшается захват кровью молекул кислорода. А
снижение кислорода в крови вызывает нарушение кислотно-щелочного баланса
в организме. (И «Орбит» без сахара тут не поможет! :-))
Не довести аквариум до такого печального состояния помогает фильтрация, аэрация и регулярная подмена воды.
Нитриты (NO2)
Нитриты образуются, когда соли аммиака окисляются в соли азотной кислоты.
Окончательный результат этого процесса – нитраты (NO3), а нитриты – это промежуточная стадия.
Опасность нитритов в том, что они так же, как и аммоний,
снижают способность молекул крови захватывать и переносить кислород.
Даже в небольших количествах нитриты в аквариуме опасны.
Нитраты (NO3-)
Нитраты не столь ядовиты, как нитриты. Но если рыбки
долго находятся в воде, где велико количество нитратов, жабры их
постепенно становятся бледными. Рыбки могут стать менее активными, у них
может затруднится дыхание и нарушиться координация движений. Они могут
почесываться о подводные камни и коряги.
Но главная опасность нитратов в том, что при определенных условиях они могут снова перейти в нитриты.
Со всеми перечисленными выше бедами можно бороться
сравнительно простыми способами. Мы он них уже говорили не раз, но от
этого они не перестали быть менее правильными:
Нужно поддерживать чистоту в аквариуме, иметь там
постоянную аэрацию, регулярно подменивать часть воды на свежую, не
перегружать аквариум рыбками и растениями. (Содержание именно нитратов в
аквариуме ограничивают водные растения и регулярная подмена воды.)
А чтобы определить параметры воды (pH, жесткость,
аммиак, аммоний, нитриты, нитраты и т. д.), теперь не обязательно идти в
химическую лабораторию. Достаточно купить в зоомагазине специальные
наборы для контроля воды, их производят многие специализирующиеся на
этом фирмы (например, «Aqvarium Pharmaceuticals»,»Tetra»).
Когда состав воды вам станет известен, чтобы ваши
питомцы чувствовали в ней себя хорошо, можно пойти двумя путями. Или
подобрать таких рыбок и такие растения, которые подходят к вашей воде.
Или изменить состав воды так, чтобы она по жесткости и pH подходила
вашим любимцам.
Для большинства аквариумных жителей вполне годится вода
средней жесткости(8 – 12 dH), активной реакции (pH7) и температуры (24 ±
2 °C). Кроме этого, они могут приспосабливаться к не совсем
благоприятным условиям (до некоторого предела).
Прежде, чем заняться евроремонтом в аквариуме,
желательно узнать хотя бы приблизительную жесткость и водородный
показатель pH воды, которая течет из вашего крана. А затем можно
посоветоваться со специалистом, он подскажет, какие рыбы и растения вам
подойдут. | 


